PROYECTOS
INICIO DEL PROYECTO: JUNIO 2017
Importe del proyecto: 29.900 €
DURACIÓN : 2 AÑOS
Grupo de Investigación de Oncología Pediátrica. IIS BioCruces
Los linfomas son uno de los grupos de tumores más frecuentes en niños y adolescentes. Existen varios tipos y sus características son diferentes en niños y adultos. Queremos investigar en un tipo concreto que se llama linfoma linfoblástico (LBL) y que comparte muchas características con un tipo de leucemia linfoblástica aguda (LLA), la de células T. A pesar de que la supervivencia ha mejorado mucho, el pronóstico de los pacientes con este tipo de linfoma es peor que los de las células B, y las posibilidades de curación en los niños que recaen son escasas, a pesar de utilizar tratamientos intensivos con mucha toxicidad.
En la última década, el desarrollo de nuevas técnicas de estudio del genoma completo y de secuenciación de nueva generación ha permitido avanzar en el conocimiento de la biología y la complejidad de estos linfomas. Concretamente en LBL de origen en célula T (T-LBL) se han definido un conjunto de marcadores que podrían ayudar a mejorar la clasificación de los pacientes según su riesgo y contribuir a la individualización de los tratamientos. Si se valida el valor pronóstico de estos marcadores o se descubren nuevos factores, se podría favorecer que los tratamientos sean más personalizados. Permitirá a los pacientes con bajo riesgo beneficiarse de terapias menos intensas, mientras que aquellos tumores de comportamiento más agresivo serán sometidos a tratamientos más intensivos o nuevas terapias. Con el presente proyecto pretendemos evaluar los marcadores moleculares ya descritos e identificar nuevas alteraciones genéticas que permitan conocer mejor las características de este tipo de linfomas. Además estudiaremos su relación con los datos clínicos y la supervivencia de los pacientes. Mediante el uso de técnicas moleculares avanzadas, pretendemos identificar una serie de marcadores que nos permitan mejorar la clasificación de estos linfomas y diseñar terapias más adaptadas. Los resultados obtenidos en este proyecto, pueden tener un impacto directo en el diagnóstico y tratamiento de pacientes infantiles con esta enfermedad. Esta propuesta se enmarca dentro de un proyecto europeo más amplio de estudio de los linfomas pediátricos. En el IIS BioCruces realizaremos los estudios moleculares de los linfomas linfoblásticos y colaboraremos con el grupo europeo de Linfoma No Hodgkin infantil y el grupo de linfomas de la Sociedad Española de Hematología y Oncología Pediátricas (SEHOP). El equipo investigador está formado por biólogos y oncólogos infantiles. El dinero recaudado para esta investigación se destinará a adquirir los materiales necesarios para los análisis genéticos, la interpretación de los datos y para la difusión de los resultados conseguidos. El proyecto se desarrollará a lo largo de 2 años, entre 2017 y 2019.
INICIO DEL PROYECTO: ENERO 2017
Importe del proyecto: 29.000€
DURACIÓN : 3 AÑOS
ANTECEDENTES
Las leucemias son las neoplasias más frecuentes en niños y adolescentes. En esta edad, El 90-95% de los casos son leucemias agudas: leucemias linfoblásticas (LLA) el 80% y mieloides (LAM) el 20%. Teniendo en cuentra todos los casos de cancer pediátricos, la LLA representa aproximadamente un tercio.
En la práctica clínica actual de las leucemias se requieren diferentes tipos de análisis para el diagnóstico y la monitorización de los pacientes, tanto en el manejo inicial como en la valoración de la respuesta al tratamiento, en la detección de la enfermedad mínima residual y en el diagnóstico de las recaídas hematológicas.
La importancia de la caracterización genética mediante el uso de técnicas de citogénetica y biología molecular es fundamental en el diagnóstico, pronóstico y toma de decisiones terapeúticas. Se requieren análisis múltiples en sangre y médula ósea para la determinación de la proporción y morfología de las células malignas (% de blastos en médula ósea) y para los estudios de citogenética (cariotipo). Los estudios actuales permiten detectar numerosas aberraciones genéticas, pero tienen todavía muchas limitaciones, por lo que es importante introducir nuevas técnicas que permitan complementar los resultados de genómica.
En este sentido, los estudios de proteómica pueden contribuir a la identificación de numerosas proteínas en líquidos biológicos que están alteradas en diferentes enfermedades. Estos estudios son complejos y necesitan de una posterior validación para identificar el conjunto de marcadores implicados en las enfermedades. Además, cada vez existen más indicios para pensar que existen cambios, no sólo cuantitativos, sino que también puede variar la presencia de unas ciertas proteínas en diferentes momentos evolutivos o la propia proteína puede sufrir cambios en su estructura final (fosforilación, metilación, acetilación).
Por otro lado, las técnicas de citometría de flujo han ganado relevancia durante los últimos años en el contexto del estudio de la respuesta inmune frente al cáncer. El estudio del inmunofenotipo mediante la citometria de flujo constituye una parte fundamental en el proceso de diagnóstico de los pacientes con LLA por su gran importancia en las decisiones terapeúticas. Permite diferenciar el tipo de leucemia (precursores B, T), el origen de los blastos y la enfermedad minimal residual (EMR). En la práctica habitual se realizan estudios seriados de citometría.
En el grupo de oncología pediátrica desarrollamos investigaciones con estas técnicas como: estudios genéticos en LLA y análisis de citometría y proteómica en infecciones graves. Esta experiencia nos anima a iniciar un nuevo abordaje de estudio de las leucemias para conocer mejor el papel de la respuesta inmune en los niños y adolescentes con cáncer. Sabemos que una respuesta inmune adecuada frente a una célula tumoral es el resultado de un delicado equilibrio entre señales activadoras e inhibidoras y que existen muchos mecanismos para lograr este equilibrio. Entre ellos, destaca la expresión de receptores activadores e inhibidores en la superficie de las células implicadas en las defensas frente a infecciones y en la vigilante frente a la proliferación de las células malignas. En este proyecto, a través del estudio de ciertos marcadores biológicos pretendemos profundizar en el conocimiento del sistema inmune de los niños con cáncer. Además, pretendemos combinar los diferentes biomarcadores de genómica, proteómica y citometria de flujo y analizar esta información con la que se obtiene de la práctica clínica habitual para avanzar en el conocimiento de la patogenia de esta enfermedad en los niños y adolescentes. En el futuro, estos estudios podrían proporcionar paneles de diagnóstico, pronóstico o seguimiento de la enfermedad para avanzar en la individualización de los tratamientos y en nuevas terapias.
OBJETIVOS
1. Avanzar en el conocimiento de la respuesta inmune en niños y adolescentes diagnosticados de LLA.
2. Aplicar las técnicas de proteómica y citometría de flujo para la identificación de nuevos marcadores para el diagnósticos y seguimiento de las LLA.
METODOLOGÍA DE INVESTIGACIÓN
GENÓMICA
Se integrarán los resultados obtenidos en los estudios citogenéticos y moleculares que se realizan a nivel clínico en todos los niños diagnosticados de LLA junto a los obtenidos del proyecto actual titulado: “Estudio de nuevos métodos de extracción de ADN en muestras almacenadas de médula ósea de niños con leucemia para investigar en nuevos marcadores genéticos con valor pronóstico y farmacogenéticos”, cuya IP es la Dra Itziar Astigarraga Aguirre que comenzó en abril 2015 gracias a la donación de La Cuadri del Hospi y el convenio firmado con el Instituto de Investigación BioCruces. Además se aprovechará los resultados de los numerosos proyectos de investigación desarrollados por la Dra. Africa García-Orad de la UPV/EHU e investigadora de BioCruces en el campo de la genética en las leucemias infantiles.
PROTEÓMICA
Pretendemos identificar y cuantificar proteínas así como estudiar sus cambios de estructura en las diferentes etapas de la enfermedad como nuevo abordaje para comprender las bases moleculares de la LLA. Para ello realizaremos el estudio basado en el enriquecimiento selectivo a nivel peptídico de las formas modificadas y su posterior análisis mediante espectrometría de masas libre de marcaje. Los pasos metodológicos serán:
1.- Extracción de proteína de las muestras de pacientes y controles
Digestión de la proteína con tripsina mediante FASP.
Enriquecimiento de los péptidos resultantes mediante anticuerpos (Metilación y Acetilación) y resina TiO2 (fosfopéptidos).
Los péptidos purificados se analizarán mediante cromatografía líquida a escala nano acoplada a espectrometría de masas (nLC MS/MS).
Análisis de datos mediante Progenesis IQ.
Validación mediante técnicas de espectrometría de masa del tipo targeted (p.e. Selected Reaction Monitoring) o tipo ELISA utilizando los anticuerpos contra las modificaciones deseadas.
Estos análisis se realizán en I.I.Biocruces en colaboración con la plataforma de proteómica del CIC bioGUNE donde trabajan los Drs. Elortza y Azkargorta que cuenta con equipos de alta resolución como Synapt G2Si (Waters), Orbitrap XL (ETD) y nano-Acquity (Waters). El grupo liderado por el Dr. Elortza tiene amplia experiencia en el estudio de proteomas mediante nLC MS/MS, y de proteínas modificadas post-traduccionalmente. El grupo de oncología pediátrica colabora con este equipo investigador en el estudio de las sepsis graves desde 2010.
CITOMETRIA DE FLUJO
Pretendemos estudiar el papel ciertos receptores inhibidores en la respuesta sistema inmune en el caso de la LLA.
Analisis de la expresión de CD300a PECAM-1 and LAIR en lineas tumorales de la células B de pacientes con LLA tipo B.
A partir de unos 5-15 ml de sangre periférica (dependiendo del peso y estado del paciente/control) se obtendrán células mononucleares PMBCs mediante Ficoll-Paque.
Analisis de la expresión de CD300a PECAM-1 and LAIR, BTLA, CEACAM1 (CD66A), CD22 (SIGLEC2), FCRL2 (SPAP1, IRTA4) en pacientes con LLA y en individuos sanos.
Estos estudios se realizaran en la plataforma Citometria de Flujo del Instituto de Investigación Sanitaria BioCruces, y bajo la supervisión del investigador IkerBasque, Dr. Borrego, inmunólogo especialista en esta temática y jefe del grupo de Inmunopatología del I.I.BioCruces. El grupo de oncología pediátrica tiene varios proyectos activos con este equipo investigador en el campo de las infecciones y el cáncer.
INTEGRACIÓN DE LOS RESULTADOS DEL PROYECTO CON LOS DATOS CLÍNICOS DE LOS PACIENTES
Se diseñará una base de datos para esta línea de investigación en la que se recojan tanto las variables obtenidas de la práctica clínica habitual como de la investigación básica. Esta base de datos se realizará cumpliendo la Ley actual de protección de datos 15/1999.
Este estudio tiene un carácter fundamentalmente exploratorio y de búsqueda de perfiles a partir de la combinación de datos clínicos, de laboratorio, genéticos, inmunológicos y de evolución que se agrupan tanto en variables cuantitativas como cualitativas, por lo que se determinarán en cada caso los métodos apropiados para su análisis estadístico. El enfoque general será el de una aproximación de Ingeniería de Datos (Data Mining), con utilización de diversas técnicas multivariables, en función de la cantidad y tipo de datos a analizar. En un segundo paso, se realizarán estudios de correlación, análisis de clusters, análisis factorial de correspondencias múltiples, tree regresión, etc. Los resultados se revisarán conjuntamente con personas expertas en Medicina Cuantitativa, Epidemiología y Metodología de la Investigación que forman parte de las Unidades de Apoyo a la Investigación del Instituto BioCruces.
La puesta en marcha de este proyecto se realizará tras la aprobación del Comité de Etica de Euskadi. Todos los pacientes y controles incluidos en el estudio firmarán un consentimiento informado previo de participación, de acuerdo con la ley de investigación Biomédica 14/2007
INICIO DEL PROYECTO: ENERO 2017
Importe del proyecto: 28.000€
DURACIÓN : 3 AÑOS
RESUMEN
La molécula CD300a se expresa en la superficie de las células B sanas y cancerosas. Esta molécula regula diversos procesos celulares. Nuestro grupo ha descubierto que las moléculas CD300 reconocen dos lípidos denominados fosfatidilserina (PS) y fosfatidiletariolamida (PE), que se expresan en la membrana plasmática de células en proceso de muerte, células activadas o incluso en células malignas. A través de su unión a lípidos, CD300a tiene un papel muy importante en la patogénesis de ciertas enfermedades, como el cáncer. El grupo del Dr. Borrego ha demostrado previamente que CD300a tiene un papel importante en la regulación de las señales mediadas por el receptor de las células B (BCR o B cell receptor por sus siglas en inglés) en células B normales. En este proyecto, proponemos estudiar el papel “oncogénico” de CD300a en la proliferación y supervivencia de tumores. de células B. Estudiaremos la capacidad de los lípidos PS y PE de modular las señales a través del BCR en células tumorales.
ANTECEDENTES
Una respuesta inmune adecuada es el resultado de un delicado equilibrio entre señales activadoras (aceleran) y señales inhibidoras (frenan), y la pérdida de este delicado equilibrio puede ocasionar diversas patologías, entre otras, el cáncer. Las señales de activación que reciben las células pueden ser negativamente reguladas por receptores (o moléculas) de membrana que contienen motivos inhibidores de señalización basados en tirosina, conocidos como ITIMs por sus siglas en inglés (immunoreceptor-tyrosine-based inhibitory motifs), Entre los receptores que contienen ITIMs y se expresan en células de tipo B encontramos el Fc RIIB, CD22, PIR-B, CD85j, FCRL4, y LAIRI, entre otros. En las células B, la ligación conjunta del receptor activador BCR y receptores inhibidores que contienen motivos a lTIM resulta en la atenuación de la señal activadora, lo que permite controlar la proliferación y activación de estas células. Dependiendo del estadio de desarrollo o nivel de activación de las células B, éstas expresan diferentes receptores inhibidores en su superficie. En este sentido, hay trabajos en los que se ha descrito cómo la expresión de ciertos receptores inhibidores, como por ejempto FCRL4 y CD85j, está aumentada en subtipos específicos de células B que se expanden en ciertas patologías infecciosas. Del mismo modo, se ha descrito recientemente que, en comparación con las células B normales, ciertas células B malignas, como las que se observan en la leucemia linfoblástica aguda (LLA) Philadelfia + o en el Linfoma Difuso de células B grandes (DLBCL), presentan mayor expresión de receptores inhibidores con motivos ITIMs, los cuales podrían tener un papel importante en el crecimiento tumoral.
CD300a es un receptor inhibidor que contiene 4 motivos ITIMs y que se expresa en células tanto del linaje linfoide como del mieloide. Nuestro grupo ha descrito previamente que el receptor CD300a se expresa en células B humanas sanas y que ejerce una función inhibidora sobre la señal activadora mediada por el BCR. Las células B más inmaduras presentan poca expresión de CD300a, mientras que su expresión varía en células B de tipo memoria y plasmablastos (Figura IA). Además, recientemente hemos descrito que la expresión de CD300a en células de tipo B varía también con la edad, siendo mayor en las células B de un adulto que de un recién nacido (Figura IB).
FIGURA I. A) EXPRESIÓN DE CD300A EN DIFERENTES SUBPOBLACIONES DE CÉLULAS 3. LAS CÉLULAS B MÁS INMADURAS PRESENTAN POCA EXPRESIÓN DE CD300A, MIENTRAS QUE SU EXPRESIÓN VARÍA EN CÉLULAS B DE TIPO MEMORIA Y PLASMABLASTOS.

FIGURA IB) COMPARACIÓN DE LOS NIVELES DE EXPRESIÓN DE CD300A EN CÉLULAS B DE ADULTOS (EN ROJO) Y RECIÉN NACIDOS (AZUL). NAIVE RESTING TLM MEMORY.
El papel de la familia de receptores CD300 en diversas patologías, su posible uso como biomarcadores y su uso potencial como dianas terapéuticas ha sido bien estudiado durante los últimos años. Así, se ha visto que CD300a se expresa de manera diferente en células LLA en comparación con células B inmaduras normales. Además, el CD300a se incluye entre los 16 biomarcadores validados para la detección de la enfermedad mínima residual por citometría de flujo. Más recientemente, se ha descrito que las células pre-B derivadas de LLA expresan altos niveles de CD300a, y otros receptores inhibidores como LAIRI y PECAM. Es importante mencionar que los pacientes con elevados niveles de CD300a, y otrns recpntnrps inhihidnrpq pl mnmento del diagnóstico presentan peor pronóstico de la enfer Zenarruzabeitia et al., Scjentific Repofts, ‘a usarse como biomarcador para la estretificación de pacie 2016. modelos murinos señalan un papel activador para CD300a en situaciones oncológicas, indicando que el bloqueo de la actividad de CD300a, y otros receptores inhibidores, podría ser una estrategia para el tratamiento de ciertos tipos de LLA. Este papel pro-oncogénico del CD300a también se ha descrito en el Linfoma Difuso de células B grandes (DLBCL).
Actualmente, gracias a trabajos realizados en el laboratorio del Dr. Borrego, se sabe que los lípidos fosfatidilserina (PS) y fosfatidiletanolamina (PE) son los ligandos naturales del CD300a. Estos lípidos se encuentran en la capa interna de la membrana plasmática de las células, pero se externalizan en situaciones de muerte o activación celular, como puede ser la proliferación oncogénica. La identificación de PS y PE como ligandos del CD300a, y la función pro-oncogénica de la misma, hace que nos cuestionemos el papel de estos dos fosfolípidos en la regulación de la señal activadora procedente del BCR eh células B tumorales y sanas.
Debido al importante papel de CD300a en la regulación de las señales mediadas por el BCR en células normales y a la correlación negativa de la expresión de CD300a con la supervivencia de los pacientes con LLA, uno de los tumores más frecuentes en la infancia, creemos que es importante estudiar el papel de CD300a en la supervivencia y proliferación de células B malignas. Como el CD300a se une a los lípidos PS y PE, estudiaremos la habilidad de ambos de modular las señales oncogénicas en células B.
OBJETIVOS
El objetivo principal del proyecto es estudiar el papel de CD300a en la modulación de la señalización mediada por el BCR en células B malignas. Los objetivos que proponemos son los siguientes:
– Analizar la expresión de CD300a en líneas celulares de tipo B.
– Estudiar la habilidad de anticuerpos monoclonales anti-CD300a para modular la señal oncogénica del BCR.
– Determinar la capacidad de los ligandos naturales del CD300a, PS y PE, de modular la proliferación y supervivencia de células B malignas.
– Analizar la expresión y función del CD300a en tumores primarios de tipo B.
METOLODOGÍA DE INVESTIGACIÓN
Analizar la expresión de CD300a en líneas celulares de tipo B. Analizaremos la expresión de CD3COa en varias líneas tumorales de tipo B mediante citometría de flujo. Una vez identificadas las líneas CD300a positivas las usaremos como modelo para estudiar la función de CD300a. Ya tenemos algunas líneas tipo B en el laboratorio (SUP-B15, Reh, Daudi, Ramos y Raji), pero compraremos algunas más (OCI-Ly01, VAL, OCI-Ly10, SUDHL-8, SUDHL-4, Farage, 697, BV173, 1<asumi-2, MHH-Ca113, Nalm6, RCH-ACV, SEM o TOMI) para ampliar nuestro estudio.
Estudiar la habilidad de los anticuerpos monoclonales anti-CD300a para modular la señal oncogénica del BCR. Usaremos protocolos previamente utilizados en el laboratorio para activar las células malignas tipo B a través del BCR y el CD300a. Estudiaremos mediante técnicas de citometría de flujo y western blot los intermediarios de la cascada de señalización para establecer los niveles de activación celular en presencia y ausencia de la estimulación a través del receptor CD300a.
Determinar la capacidad de los ligandos naturales del CD300a, PS y PE, de modular la proliferación y supervivencia de células B malignas. Haremos los mismos experimentos que en el punto anterior pero estimulando las células en presencia o ausencia de los lípidos PS y PE.
Analizar la expresión y función del CD300a en tumores primarios de tipo B. Analizaremos la expresión de CD300a en tumores primarios. Para ello colaboramos estrechamente con la Dra. Itziar Astigarraga del Hospital Universitario Cruces. La Dra. Astigarraga es la Jefa de Servicio de Pediatría y Líder del grupo de Oncología Pediátrica. Nuestro grupo también mantiene una estrecha colaboración con los jefes de Servicio de Hematología del Hospital Universitario Cruces y Hospital Galdalkao-osasun ikerketa institutua instituto de investigación sanitaria usansolo, los Dres. Juan Carlos García Ruiz y Tomás Carrascosa Vallejo, respectivamente, los cuales serán de gran ayuda en el desarrollo de este proyecto. Los clínicos recogerán muestras de los pacientes desde el inicio del proyectó y las analizaremos una vez realizados los experimento? con las líneas tumorales.
BIBLIOGRAFÍA
1.-: Borrego F. The CD300 molecules: an emerging family of regulators of the immune system. 2013. Blood. 121:1951-60.
2.-: Chen Z, Shojaee S, et al. Signalling thresholds and negative B-cell selection in acute lymphoblastic leul 3.-: Coustan-Smith E, Song G, et al. New markers for minimal residual disease detection in acute lymphoblastic leukemia. 2011. Blood. 117:6267-6276.
4.-: DeBell I<E, Simhadri VR, Mariano JI, Borrego F. Functional requirements for inhibitory signal transmission by the immunomodulatory receptor CD300a. 2012. BMC Immunol. 13:23.
5.-: Dimitrova M, Zenarruzabeitia O, Borrego F, Simhadri VR. CD300c is uniquely expressed on CD56bright Natural l 6.-: Jjang L, Xu Y, Zeng X, Fango, Morselll HC, Zhou Suppression of CD300A inhibits the growth of diffuse large B-cell lymphoma. 2015. Oncotarget. 6, 31:31191-31202.
7.-: Sabato V, Boita M, et al. Mechanism of phosphatidylserine inhibition of IgE/Fc Rl-dependent anaphylactic human basophil degranulation via CD300a. 2014. J Allergy Clin Immunol. 134:734737.e3.
8.-: Silvá R, Moir S, Kardava L, Debell K, Simhadri VR, Ferrando-Martínez S, Leal M, Peña J, Coligan JE, Borrego F. CD300a is expressed on human B cells, modulates BCR-mediated signaling, and its expression is down-regulated in HIV infection. 2011. Blood. 117:5870-80.
9.-: Simhadri VR, Andersen JF, Calvo E, Choi SC, Coligan JE, Borrego F. Human CD300a binds to phosphatidylethanolamine and phosphatidylserine, and modulates the phagocytosis of dead cells. 2012. Blood. 119:2799-809.
10.-: Zenarruzabeitia O, Vitallé j, Eguizabal C, Simhadri VR, Borrego F. The Biology and Disease Relevance of CD300a, an Inhibitory Receptor for Phosphatidylserine and Phosphatidylethanolamine. 2015. J Immunol. 194:5053-60.
11.-: Zenarruzabeitia O, Vitallé J, García-Obregón S, Eguizabal C, Astigarraga l, Simhadri VR, Borrego F. The expression and function of human CD300 receptors are differentially regulated during the development. 2016. Scientific Resports 6:32693.
INICIO DEL PROYECTO: ENERO 2017
Importe del proyecto: 45.000€
DURACIÓN : 3 AÑOS
RESUMEN
El proyecto pretende el estudio de los sarcomas óseos infantiles, que representan varios tipos de cánceres muy agresivos que afectan a niños y adolescentes, en los que la supervivencia se sitúa alrededor del 65% de los casos. El tratamiento actual basado en cirugía, quimioterapia y/o radioterapia no permite la curación de muchos niños (alrededor de un tercio de los pacientes con formas localizadas, la mayoría de los niños con metástasis o los que recaen tras los tratamientos convencionales). La supervivencia de este tipo de tumores apenas ha mejorado en los últimos años y todavía no se puede aplicar tratamientos personalizados, por la falta de conocimiento de las bases moleculares y las dificultades para desarrollar nuevos tratamientos eficaces. Además, en muchas ocasiones los niños sufren de secuelas graves por amputaciones o cirugías agresivas ortopédicas o por los efectos de los fármacos actuales de quimioterapia que pueden afectar al corazón, pulmón, audición etc. La investigación para avanzar en el conocimiento de los sarcomas óseos es muy importante para diseñar nuevas terapias que permitan mejorar la supervivencia y la calidad de vida de las personas afectadas.
OBJETIVOS PRINCIPALES PLANTEADOS
- Caracterizar las alteraciones genéticas que presentan los sarcomas óseos, con el objetivo de identificar alteraciones comunes que permitan diagnosticar con más fiabilidad y, potencialmente, buscar tratamientos que se dirijan contra dichas alteraciones específicas de estos tumores.
- Identificación de nuevas dianas terapéuticas a través de la exposición de líneas celulares derivadas de tumores primarios de los pacientes a numerosos nuevos fármacos y medir y evaluar la respuesta de cada una de las líneas celulares de los diferentes pacientes.
- Realizar nuevos estudios genéticos de análisis de microRNAs desregulados o mutados en el tejido tumoral y en el plasma de los pacientes pediátricos afectados para determinar su valor pronóstico y su correlación con la presentación y evolución clínica.
- Aplicar los descubrimientos sobre la caracterización molecular de los sarcomas óseos al desarrollo de nuevas formas de detección de metástasis, y de identificación de células tumorales circulantes en fases más precoces.
- Desarrollar estas pruebas conocidas como biopsia líquida, test de ADN tumoral circulante o test de biomarcadores en sangre, para la detección precoz de células de sarcomas óseos en estos pacientes.
- Mejorar la supervivencia y la calidad de vida de niños con sarcomas óseos a través de generar nuevas herramientas que permitan un diagnóstico más preciso, tanto a nivel genómico como biológico, y del desarrollo de terapias más específicas e individualizadas para los niños.
- Desarrollar la actual colaboración entre los institutos de investigación, universidades y unidades hospitalarias dedicadas al cáncer infantil, para trasladar los resultados de la investigación a la mejora de los métodos diagnósticos y al aumento de las opciones terapéuticas, que se puedan ofrecer a los niños afectados en el País Vasco, Navarra y en otras Comunidades Autónomas.
- Fomentar las colaboraciones nacionales e internacionales para aunar sinergias en la búsqueda de nuevos tipos de terapia contra el cáncer infantil. Se pretende, por ejemplo, el uso en el presente proyecto de la metodología de análisis de fármacos de alto rendimiento elaborada por el Dr. Charles Keller.
ACCIONES Y METODOLOGÍA PREVISTA
Para conseguir los objetivos propuestos se proponen los siguientes planes metodológicos:
- Selección de los pacientes con sarcomas óseos que acepten participar en el estudio.
- Diseño de una base de datos y recogida de los principales datos clínicos, analíticos y radiológicos en el momento del diagnóstico y en diferentes momentos evolutivos (previo y posterior a cirugía, cada 3-6 meses durante la quimioterapia, previo y posterior a radioterapia, en recaída).
- Aislar células de tumores primarios de niños afectos de sarcomas óseos, recogiendo la muestra estéril en quirófano y creando una línea celular de cada tumor.
- Caracterizar la genética de los tumores óseos primarios a través de la secuenciación con las nuevas técnicas de next generation sequencing, NGS.
- Exponer las líneas celulares generadas a un número suficiente de fármacos nuevos como para poder identificar nuevos fármacos potencialmente eficaces para estos niños.
- Extracción del RNA del tejido tumoral para la búsqueda de alteraciones de la regulación o mutaciones en los microRNAs de niños y adolescentes con sarcomas óseos.
- Detección en plasma de los microRNAs desregulados o mutados en niños y adolescentes con sarcomas óseos mediante secuenciación de RNA (RNA seq) y selección de las alteraciones que puedan tener implicación clínica.
- Correlación de los resultados genéticos tumorales y sanguíneos con los datos clínicos, respuesta al tratamiento y pronóstico para identificar nuevas dianas terapéuticas.
- Explorar si los nuevos resultados obtenidos en los tumores óseos pediátricos son aplicables a los adultos con sarcomas óseos para establecer nuevos proyectos colaborativos en el futuro.
- Valorar si los hallazgos genéticos conseguidos en esta investigación sobre sarcomas óseos son aplicables a otro tipo de sarcomas infantiles localizados en partes blandas, vísceras etc. y tratar de valorar la aplicación de nuevos fármacos en los tipos de tumores que comparten similares alteraciones moleculares.
- Difundir el conocimiento generado en este proyecto de investigación para facilitar el desarrollo de nuevas terapias que consigan aumentar las tasas de supervivencia y la reducción de las secuelas que padecen los niños y adolescentes con sarcomas óseos.
- Participar en iniciativas científicas y sociales para fomentar la investigación en el cáncer infantil y el desarrollo de terapias más curativas y menos tóxicas.
DISTRIBUCIÓN DE LAS ACTIVIDADES INVESTIGADORAS
El proyecto será liderado por la Dra Aizpea Echebarria Barona como investigadora principal y por la Dra. Itziar Astigarraga como responsable del grupo de Oncología Pediátrica y del área de Investigación Materno-Infantil del Instituto de Investigación BioCruces. Se encargarán del diseño detallado del estudio, información a las familias y petición de consentimientos informados, reclutamiento de los pacientes, organización para la adecuada obtención del tejido tumoral y muestras, diseño de la base de datos, análisis de los resultados clínicos y biológicos y difusión de los resultados a nivel científico y social. Estas acciones se recogen en las acciones previas 1, 2, 8-12.
Los estudios de caracterización genética de los sarcomas óseos, creación de líneas celulares tumorales, exposición de las células tumorales a nuevos fármacos, valoración de la respuesta celular a estos fármacos y aplicación de los estudios moleculares para desarrollar nuevas formas menos invasivas de identificación de las células tumorales en sangre (biopsia líquida) serán desarrolladas en el Laboratorio de Pediatría de la Clínica Universitaria de Navarra, bajo la dirección de la catedrática de Genética, Dra. Ana Patiño García. Se responsabilizará de las acciones indicadas en los puntos 3, 4, 5, 8-12.
La investigación de epigenética y análisis de microRNAs en tejido tumoral y en sangre de los niños y adolescentes diagnosticados de sarcomas óseos serán realizados en el Departamento de Genética de la Universidad del País Vasco (UPV/EHU) en el equipo liderado por la profesora titular Dra. África García-Orad. Se encargará de las acciones señaladas en los puntos 6,7, 8-12.
EQUIPO INVESTIGADOR Y TRAYECTORIA CIENTÍFICA RESUMIDA
En este proyecto se plantea la colaboración multidisciplinar de investigadores clínicos y básicos con perfiles complementarios de instituciones hospitalarias y universitarias. La trayectoria investigadora de las 3 entidades participantes y de los investigadores participantes es larga y reconocida a nivel nacional e internacional en el campo de la oncología pediátrica y de los sarcomas óseos.
El Instituto de Investigación Sanitaria BioCruces, instituto de Investigación del Hospital Universitario Cruces será la entidad que coordinará el proyecto. BioCruces se creó en el año 2008, fue acreditado por el Instituto de Salud Carlos III (ISCIII) en 2015, pero tiene una consolidada trayectoria docente e investigadora y una misión dedicada a potenciar de forma preferente la investigación traslacional y aplicada a las necesidades de salud de los pacientes. Dentro del Instituto BioCruces, el encargado de llevar a cabo la propuesta será el grupo de Oncología Pediátrica (http://www.biocruces.com/web/biocruces/bc7.05). Este grupo liderado por la Dra. Itziar Astigarraga, jefa del servicio de pediatría, esta integrado por un total de 12 investigadores multidisciplinares que aportan una visión complementaria sobre el cáncer infantil. Dentro del grupo de oncología, se ha desarrollado una plataforma de apoyo a la investigación en cáncer infantil, cuyos objetivos generales son: Mejorar la curación y la calidad de la vida de los niños y adolescentes con cáncer; Facilitar el acceso a nuevas terapias y a tratamientos estándar, al igual que en toda Europa; Desarrollar terapias específicas según los avances en el conocimiento de la biología tumoral; Colaborar con otros organismos dedicados a la investigación, especialmente con los dedicados específicamente al cáncer del niño y adolescente, con el Instituto virtual europeo de investigación en cáncer del niño y del adolescente propuesto por ENNCA, con instituciones hospitalarias, universitarias y empresas para contribuir a que el apoyo a esta investigación sea sostenible a largo plazo. Además entre las acciones propuestas en la plataforma están la colaboración con sociedades científicas dedicadas a la infancia y al cáncer, el apoyo a las asociaciones de pacientes en las iniciativas relacionadas con la investigación en cáncer, y establecer nuevas formas de comunicación y de información a los pacientes y familiares.
La investigadora principal del proyecto será Aizpea Echebarria, licenciada en Medicina con la especialidad de Oncología Pediátrica, y miembro de la Unidad de Onco-Hematología Pediátrica del Hospital Universitario Cruces y BioCruces. Actualmente participa en varios proyectos de ámbito nacional e internacional centrados en el tratamiento de neoplasias pediátricas. Además, forma parte de la plataforma de apoyo a la investigación sobre cáncer en niños y adolescentes del País Vasco centralizada en la Unidad de Oncología pediátrica del Hospital Universitario Cruces. Ha comenzado recientemente su carrera investigadora, pero posee numerosas comunicaciones a congresos nacionales e internacionales. Está realizando su tesis en farmacogenética de leucemia linfoblásticas agudas infantiles y tiene una larga experiencia en los sarcomas pediátricos. Es la investigadora principal de los ensayos clínicos de Sarcoma de Ewing y Osteosarcoma que se están desarrollando actualmente en España, Europa y Hospital Universitario Cruces (Grupo GEIS).
El equipo investigador de BioCruces (HU Cruces) está constituido por 5 oncólogos pediátricos (Aizpea Echebarria Barona como IP, Itziar Astigarraga Aguirre, Ricardo López Almaraz, Rosa Mª Adán Pedroso, Miguel Alejandro Garcia Ariza) y 2 biólogas dedicadas a la investigación en el cáncer infantil (Susana Garcia Obregón, Idoia Martin Guerrero). También colaborarán los servicios de Anatomía Patológica (Laura Zaldumbide), Traumatología (Luis Areizaga y Josu Merino), Radiodiagnóstico (Fermín Sáez, Armando Gozalo, María Berastegui).
Este proyecto se realizará en colaboración con Ana Patiño directora de la Unidad de Genética Clínica de la Clínica Universidad de Navarra y catedrática de Genética de la Universidad de Navarra. Su cv es muy extenso y puede consultarse aquí. Su trayectoria investigadora se ha centrado en el cáncer infantil con una dedicación preferente a los sarcomas óseos, como demuestran sus numerosas publicaciones sobre este tema en las mejores revistas científicas. Dispone de excelente equipamiento para la realización de los estudios genéticos en Pamplona y una gran experiencia en la interpretación de estudios genéticos y en generación de líneas celulares de osteosarcoma con buenos apoyos de expertos internacionales. Contará con la ayuda de personal de laboratorio y con la bióloga Marta Zalacain Diez.
La Dra. África Garcia-Orad es profesora Titular de Genética en la Universidad del País Vasco UPV/EHU con la acreditación de Cátedra de la ANECA y forma parte del Grupo de Oncología Pediátrica del II BioCruces desde su creación. Ha mantenido una colaboración científica muy estrecha con este grupo. Tiene una amplia experiencia en el campo de genética y epigenética del cáncer infantil avalada por sus más de 30 años de experiencia, mas de 60 publicaciones científicas, 150 presentaciones a congresos. Ha participado en 50 proyectos de investigación de los que ha sido IP de 21 de ellos. Desde 2009 es IP de un grupo consolidado de investigación del Gobierno Vasco, ha coordinado el grupo de Genética y Epigenética de la Red Nacional de Investigación de Cáncer (RTICC) con 35 investigadores de 12 Centro y un Nodo de la Red de Cáncer desde 2006-2012. Ha dirigido numerosas tesis, varias sobre cáncer pediátrico y en 2015 una sobre osteosarcoma.
En su equipo colaborarán también las biólogas Idoia Martín Guerrero y Ángela Gutiérrez Camino.
INICIO DEL PROYECTO: MARZO 2015
Importe del proyecto: 28.000€
DURACIÓN : 3 AÑOS
Una de las líneas de investigación que estamos trabajando es para que los niños enfermos de cáncer puedan superar la secuela de la esterilidad, que pueden causar los tratamientos agresivos contra la enfermedad, y albergar la esperanza de ser padres en un futuro.
El proyecto de investigación, que será desarrollado por el equipo de Dra. Cristina Eguizabal en la Unidad de Terapia Celular y Células Madre en colaboración con el equipo de Pediatras liderado por la Dra. Itziar Astigarraga de la Unidad de Oncología Pediátrica del Hospital Universitario Cruces y por el grupo que lidera Dr. Roberto Matorras en la Unidad de Reproduccion Asistida del Hospital Universitario Cruces y por el grupo que lidera Asunción Azpeitia de Cirugía Pediátrica del Hospital Universitario Cruces.
Algunos de los tratamientos que se utilizan para combatir el cáncer pueden ocasionar que, en el futuro, estos pacientes a pesar de estar curados de su enfermedad, presenten efectos secundarios, entre ellos que sean incapaces de tener descendencia. Este hecho se produce porque la radioterapia y algunas quimioterapias dañan unas células madre específicas que se encuentran en los testículos, que se llaman células madre espermatogénicas.
La imposibilidad de tener descendencia puede afectar mucho a la calidad de vida de los supervivientes de un cáncer pediátrico y hasta la fecha las posibilidades para evitar este efecto secundario han sido muy limitadas.
Los varones adultos tienen la opción de congelar semen antes de iniciar dichos tratamientos, pero los niños prepúberes (aquellos que no han alcanzado la pubertad o madurez sexual) no cuentan con esa alternativa, ya que son incapaces de producir espermatozoides maduros que puedan ser conservados.
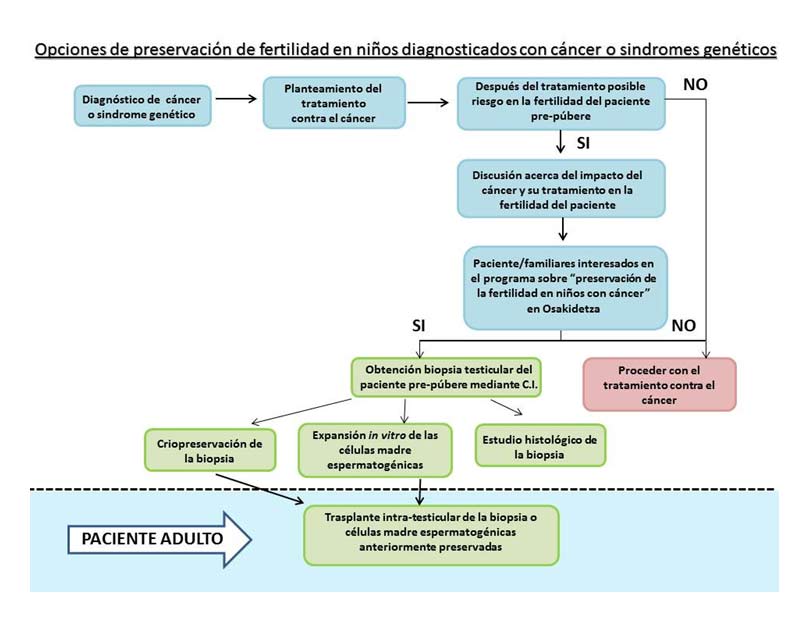
La base de este proyecto consistiría en guardar congelado parte del tejido testicular de estos niños (con sus células madre espermatogénicas), antes de que inicien un tratamiento que pudiera resultar tóxico a ese nivel. El primer objetivo a corto plazo, seria optimizar en el laboratorio los protocolos de cultivo, expansión y congelación de las células madre espermatogénicas. El segundo objetivo a largo plazo es que en el futuro, si ese paciente tuviera dificultades para tener descendencia y así lo considera el clínico responsable, se le pudiera realizar un autotrasplante del tejido en sus propios testículos y ese tejido una vez insertado, reiniciara la maduración de las células reproductoras y sea capaz de producir espermatozoides maduros con capacidad para fecundar.
Para ello como se muestra en la Figura 1, se propone un estudio para establecer un programa de preservación de la fertilidad en niños con cáncer o síndromes genéticos, siendo pionero en Euskadi.
Figura 1
EQUIPO DE INVESTIGACIÓN EN ESTE PROYECTO:
EQUIPO DE INVESTIGACIÓN DEL CENTRO VASCO DE TRANSFUSIÓN Y TEJIDOS HUMANOS (CVTTH).
– Cristina Eguizabal, Investigadora Principal. Ella supervisará directamente todo el trabajo relacionado con el proyecto que se llevarán a cabo principalmente en CVTTH. Además, la Dra. Eguizabal trabajará parcialmente en partes del proyecto junto con los demás compañeros. Además tendrá un papel indispensable en el futuro establecimiento del nuevo programa de preservación de la fertilidad para los niños con cáncer en Osakidetza (Centro Vasco de Transfusión y Tejidos Humanos / Hospital Universitario Cruces).
– Miguel Ángel Vesga, Hematólogo y Director Médico de CVTTH. Médico Hematólogo que tiene un papel indispensable para la obtención de las muestras de sangre de todos los donantes sanos que se utilizarán en este proyecto. Además, participará activamente en el diseño de los experimentos que llevan a cabo en este proyecto.
– Silvia Santos, Responsable del Banco de Sangre de Cordón Umbilical y de Tejidos en el CVTTH. La Dra. Santos proporcionará y llevará a cabo junto con la Dra. Eguizabal los protocolos de congelación lenta y vitrificación de biopsias testiculares humanas.
– Lara Herrera y Ane Orrantia, becarias predoctorales son fundamentales para desarrollar este proyecto de investigación para su tesis doctoral, por tanto estará al tanto de todo el proyecto.
-Juanma Salcedo, Técnico de Laboratorio de Investigación. Él estará a cargo de la mayor parte del trabajo en el laboratorio.
EQUIPO DE INVESTIGACIÓN ubicado en el Instituto de Investigación Sanitaria (BioCruces) – Hospital Universitario Cruces.
– Roberto Matorras, Jefe de Servicio de Ginecologia y Obstetricia-Unidad de Reproduccion Asistida del Hospital Universitario Cruces, Begoña Prieto, Ginecologa de la Unidad de Reproduccion Asistida del Hospital Universitario Cruces y Antonia Expósito Navarro, Bióloga de la Unidad de Reproducción Asistida del Servicio de Obstetricia y Ginecología del Hospital Universitario Cruces tendrán un papel indispensable para la recogida de las muestras testiculares de todos los pacientes adultos y de los niños con síndrome de Klinefelter que se utilizarán en este proyecto de investigación.
-Itziar Astigarraga, Jefe del Servicio de Pediatria y de la Unidad de Hemato-Oncología Pediátrica del Hospital Universitario Cruces y Ricardo López Almaráz, Pediatra del mismo Servicio. Ambos oncólogos pediátricos diagnosticarán y tratarán a los futuros pacientes pediátricos con cáncer. Tendrá un papel indispensable dar la información a las familias y a los pacientes para su participación en el proyecto.
-Estibaliz Solorzano, Gloria Chocarro y Asunción Azpeitia, Cirujanas Infantiles del Servicio de Cirugía Pediátrica del Hospital Universitario Cruces. Tendrán un papel indispensable en la recogida de biopsias testiculares de pacientes pediátricos que se utilizarán en este proyecto.
ASESORA CIENTIFICA ubicada en The Center for Reproductive Medicine of the Academic Medical Center (AMC) en Amsterdam (Holanda).
-Ans van Pelt, Dra en Bióloga especialista en el laboratorio de Biología Reproductiva en The Center for Reproductive Medicine of the Academic Medical Center (AMC) en Amsterdam (Holanda). Es experta y pionera programas de preservación de la fertilidad en niños pre-púberes. Su colaboración como asesora científica será fundamental para posibles problemas que puedan surgir en la ejecución del proyecto
Resultados preliminares
Recientemente se han desarrollado varios métodos de preservación de la fertilidad por un laboratorio pionero a nivel internacional como es el laboratorio de Biología de la Reproducción ubicado en The Center for Reproductive Medicine of the Academic Medical Center (AMC) en Amsterdam (Holanda) liderado por la Dra. Ans van Pelt que desde el año 2008 se dedica a criopreservar biopsias testiculares y a la expansión de espermatogonias in vitro de niños prepuberes antes se someterse a tratamientos contra el cáncer. En la actualidad somos colaboradores ambos grupos, como se demuestra en la reciente publicación (Vassena R, Eguizabal C, Heindryckx B, Sermon K, Simon C, van Pelt AM, Veiga A, Zambelli F; ESHRE special interest group Stem Cells. Stem cells in reproductive medicine: ready for the patient? Hum Reprod. 2015 Jul 22).
En el Centro Vasco de Transfusión y Tejidos Humanos (CVTTH) llevamos trabajando varios meses en la puesta a punto de un protocolo de congelación de biopsias testiculares gracias a la becaria Lara Herrera que durante su trabajo fin de master ha estado trabajado en la recogida de biopsias testiculares de adulto y algún niño con síndrome de klinefelter, como muestra la Figura 2. En este momento estamos analizando que método es el óptimo para preservar biopsias testiculares, para ello como muestra la Figura 3 hemos realizado inmunofluorescencias para detectar marcadores específicos de células madre espermatogenicas, MAGEA4 y VASA en biopsias testiculares de adulto y de niño. Todo este trabajo esta supervisado por la Dra Ans van Pelt.
Figura 2: Biopsias testiculares de adulto y pediatricas recogidas
Figura 3: Inmunofluorescencias en biopsias testiculares de adulto y pediatricas
Figura 3a: Inmunofluorescencia para la detección de marcadores de células madre espermatogenicas, MAGEA4 (verde) y VASA (rojo) en biopsia testicular de adulto.

Figura 3b: Inmunofluorescencia para la detección de marcadores de células madre espermatogenicas, MAGEA4 (verde) y VASA (rojo) en biopsia testicular pediátrica con Sindrome de Klinefelter.
INICIO DEL PROYECTO: MARZO 2015
Importe del proyecto: 18.000€
DURACIÓN : 3 AÑOS
Los niños y adolescentes con cáncer tienen una gran predisposición a sufrir infecciones graves. La infección es la causa no oncológica más importante de morbi-mortalidad en el niño con cáncer. Los cuidados de estos pacientes exigen unas medidas específicas para reducir este riesgo de infección. La investigación para aumentar el conocimiento de las familias, pacientes y profesionales sanitarios es fundamental para establecer las recomendaciones sobre estos cuidados con la mejor evidencia científica. La renovación de los protocolos hospitalarios de prevención de la infección nosocomial y de seguridad en el empleo de citostáticos y antibióticos, es clave para ofrecer a los niños oncológicos una mejor atención sanitaria. Dado que una parte del tratamiento oncológico se administra en el domicilio de los pacientes, la participación de los padres y de los propios adolescentes es fundamental para asegurar la adherencia al tratamiento y a las recomendaciones sobre sus hábitos de vida, haciéndoles más partícipes del control de su enfermedad y de las posibles complicaciones asociados al mismo. La disponibilidad de materiales informativos para los pacientes y familias puede ayudar a la disminución de dudas y preocupaciones y contribuir a mejorar la calidad de vida.
En los últimos años, estudios de investigación sobre el sistema inmune, han confirmado la importancia de éste en la lucha contra las infecciones y en la lucha contra el cáncer. El avance en el conocimiento del sistema inmune puede ser importante para conocer porqué algunos niños han desarrollado cáncer y las causas por las que padecen más complicaciones ante los mismos gérmenes infecciosos. Por ello, es crucial investigar en la implementación de nuevos protocolos que reduzcan la infección en el niño oncológico. Estos protocolos deben contener intervenciones específicas, eficaces, dirigidas e individualizadas teniendo en cuenta las distintas enfermedades oncológicas de base y la influencia que tienen los distintos cánceres sobre el sistema inmunológico del niño.
El objetivo principal de este proyecto es el inicio de una línea de trabajo, en el que se desarrollarán estrategias para reducir la infección en los niños con cáncer a través de la elaboración de nuevos protocolos con intervenciones específicas con fuerte recomendación para la práctica clínica sobre el manejo de catéteres centrales, administración de antibióticos, cuidado de la piel y mucosas, soporte nutricional, medidas de aislamiento y prevención de adquisición de patógenos nosocomiales.
También se crearan guías y material informativo dirigidos a niños, adolescentes y familiares para aumentar su conocimiento sobre su proceso oncológico, su tratamiento, los cambios de vida que debe establecer tras el diagnóstico de cáncer y recomendaciones para la prevención y detección de la infección en el domicilio.
Esta línea de trabajo se llevará a cabo en 3 fases consecutivas, de forma que todas estarán interrelacionadas entre si y el inicio de la siguiente estará condicionada por los resultados de la anterior
INICIO DEL PROYECTO: NOVIEMBRE 2015
Importe del proyecto: 23.000€
DURACIÓN : 2 AÑOS
ANTECEDENTES
Los tumores del sistema nervioso central (SNC) incluyen los tumores localizados en el cerebro, cerebelo, tronco del encéfalo y médula espinal. Por frecuencia suponen aproximadamente un 25% de los niños y adolescentes diagnosticados de cáncer en nuestro país. Es decir, 1 de cada 4 niños y adolescentes diagnosticados de cáncer, tiene un diagnóstico de un tumor de SNC.
Hay muchos tipos de tumores de SNC, y por lo tanto diferentes tipos de tratamientos. Lo que es común a todos ellos es que la localización inicial puede ser parte de un daño neurológico que en numerosos casos puede ser duradero. Lo mismo ocurre con los tratamientos necesarios para la curación, que incluyen en diferentes combinaciones cirugía, radioterapia y quimioterapia, que siendo necesarios, no son inocuos.
Los estudios que se realizan habitualmente en la evolución de los niños y adolescentes con tumores de SNC se centran habitualmente en la supervivencia de los mismos, pero una vez conseguido el objetivo de la supervivencia, no aportan información acerca de la calidad de vida y secuelas que tienen tras haber pasado por un cáncer y los tratamientos para superar el mismo.
De la misma forma, otros tipos de enfermedades oncológicas pediátricas que por su localización o extensión pudieran necesitar tratamiento sobre el sistema nervioso central, fundamentalmente radioterapia o quimioterapia intratecal (algunas leucemias o linfomas), también podrían beneficiarse de este estudio.
OBJETIVO
El objetivo del estudio de investigación es doble. El primero, mirando hacia atrás, estudiar la situación de los pacientes supervivientes de tumores de SNC o con tratamientos sobre el SNC.
En segundo lugar, mirando hacia adelante, establecer estudios y valoración neuropsicológica de los niños desde el momento de la aparición de la enfermedad y detección de los diferentes problemas neurológicos, cognitivos, psicológicos y calidad de vida durante y tras el tratamiento, para valorar el impacto real de los tratamientos y detección de las necesidades especiales que puedan precisar.
MÉTODO
Para poder realizar este estudio se contactará con niños y adolescentes supervivientes de tumores de SNC, tratados en nuestra Unidad para evaluar su situación actual a nivel neuropsicológico e investigar su calidad de vida mediante valoraciones psicológicas y utilizando medidores de calidad de vida estandarizados. Se revisará la situación actual y el posible efecto del propio tumor y de los tratamientos que fueron necesarios para poder superar su enfermedad. Al mismo tiempo se evaluarán todos los niños y adolescentes que sean nuevos diagnósticos de tumores de SNC, para estudiar los mismos parámetros desde el momento inicial, y posteriormente en diferentes momentos del tratamiento y tras la finalización del mismo.
Tras revisar los tumores de SNC, se intentará completar el estudio en los niños y adolescentes que hayan recibido tratamiento sobre el SNC por otro motivo oncológico. Se estudiarán los problemas que presenten en la actualidad y de forma prospectiva también se analizará la situación basal en los pacientes que vayan a precisar radioterapia craneal o intratecales.
EQUIPO INVESTIGADOR
El estudio se realizará en el Hospital Universitario Cruces, hospital de referencia en este tipo de tumores, dentro del Grupo de investigación en Oncología Pediátrica, liderado por la Dra Itziar Astigarraga, del Instituto de Investigación de BioCruces, y contando con la colaboración habitual de grupos de investigación nacionales e internacionales.
UTILIZACIÓN DE LOS FONDOS CONSEGUIDOS
Con el presupuesto disponible se podrán adquirir cuestionarios validados de neuropsicología y de calidad de vida, se solicitará la colaboración del personal universitario y la contratación a tiempo parcial de un psicólogo. Este investigador se dedicaría a la realización del proyecto, para poder hacer las evaluaciones neuropsicológicas y estudios de calidad de vida, tanto en los casos nuevos como en los supervivientes.
La contratación de un licenciado en el II BioCruces con una dedicación de 10 horas semanales tendría un coste anual de alrededor de 11.000€. En función de la disponibilidad de fondos se ajustará la duración y características del contrato. Se organizará una estancia formativa en neuropsicología en un centro universitario con trayectoria investigadora en este tipo de estudios en personas diagnosticadas de cáncer en la infancia y adolescencia.
INICIO DEL PROYECTO: MARZO 2015
Importe del proyecto: 35.000€
DURACIÓN : 2 AÑOS
MEMORIA CIENTÍFICA DETALLADA
El objetivo principal de este proyecto multidisplinar es conseguir la extracción de ADN de dos tipos de muestras de medulas ósea archivadas en la práctica clínica: extensiones hematológicas (citomorfología) y fijadas en metano/ácido acético glacial (citogenética). Ambos tipos de muestras son excedentes de muestras procedentes de pacientes con sospecha o diagnóstico de leucemia y poseen una antigüedad de hasta 10 años. Posteriormente se cuantificará y se estudiará la cantidad y calidad del ADN extraído mediante técnicas de cuantificación (fluorimetría y espectrofotometría) y el genotipado de algunos marcadores genéticos respectivamente. Además se evaluará la posible implantación del método en el hospital, particularmente en el Servicio de Pediatría (Oncohematología Pediátrica), Hematología, Genética y en el Biobanco para disponer de una nueva fuente de ADN, que hasta ahora no se encontraba disponible. Las muestras de ADN se utilizarán para llevar a cabo, de forma retrospectiva, estudios en la médula ósea sobre el valor diagnóstico y pronóstico de ciertos marcadores genéticos, determinación de nuevas mutaciones, análisis de farmacogenética para avanzar en el conocimiento de enfermedades tan graves como leucemias linfoblásticas agudas, leucemias mieloblásticas agudas y otras formas más raras de leucemias en niños y adolescentes.
ANEXO I.B – MEMORIA CIENTÍFICA
“MONITORIZACIÓN DE LA ACTIVIDAD ENZIMÁTICA EN PLASMA Y DETECCIÓN DE ANTICUERPOS DE LAS DIFERENTES FORMAS DE ASPARRAGINASA UTILIZADAS EN LOS PROTOCOLOS DE LEUCEMIA LINFOBLÁSTICA AGUDA Y LINFOMA NO-HODKING PEDIÁTRICO”
L-asparraginasa es un fármaco básico en el tratamiento de la leucemia linfoblástica aguda. Las células necesitan del aminoácido asparragina para sintetizar ADN y poder sobrevivir. Las células sanas son capaces de sintetizar asparragina a partir del aminoácido glutamina. Sin embargo, para las células con leucemia la asparragina es un aminoácido esencial, no pueden sintetizarlo y necesitan de la asparragina que hay en el medio extracelular. El medicamento L-asparraginasa es un enzima que consigue eliminar la asparragina del medio extracelular y, de esta manera, evitar que sea aprovechado por la células cancerosas.
Lo que ocurre con la L-asparraginasa es que, al tratarse de una proteína, el cuerpo la reconoce como una sustancia extraña y es capaz de fabricar anticuerpos contra ella. Estos anticuerpos son los responsables de que ocurran, en ocasiones, reacciones alérgicas a este fármaco. Otras veces, la presencia de estos anticuerpos no produce reacciones alérgicas, pero hacen que la l-asparraginasa esté inactiva y no funcione. Son lo que conocemos como anticuerpos silentes, porque en silencio y sin manifestaciones clínicas son capaces de neutralizar la acción del fármaco. Existen distintos tipos de asparraginasas, de tal manera que cuando se producen anticuerpos contra un tipo podemos cambiar a otro.
Lo que nos proponemos en el Hospital Universitario Cruces es ser capaces de averiguar si existen anticuerpos silentes contra L-asparraginasa, de esta manera, podría hacerse un intercambio con otro tipo de asparraginasa para garantizar que el fármaco mantenga su actividad. La manera de averiguarlo es a través de una muestra de sangre. Con dicha muestra el servicio de bioquímica del hospital intentará determinar la actividad del enzima L-asparraginasa y los niveles de asparragina en sangre. El laboratorio de inmunología la presencia de anticuerpos. Con esto datos el servicio de farmacia interpretará si el medicamento puede o no actuar de manera adecuada y se lo comunicará a oncología infantil, que cuando tenga suficientes datos constatados será capaz de establecer un protocolo de cambio de tipos de asparraginasa. Pero además se pueden conseguir más beneficios, porque si interpretamos que la actividad del medicamento es excesivamente elevada, podemos establecer protocolos que disminuyan la dosis del mismo y minimicen toxicidades. En definitiva lo que pretendemos hacer es lo que los farmacéuticos llamamos monitorización del medicamento. Como sabemos que no todos los pacientes reaccionan igual ante un medicamento, intentamos buscar “pistas” que nos indiquen porque ocurren estas diferencias. En el caso de L-asparraginasa diferentes grupos han establecido que la determinación de la actividad de L asparraginasa y/o la presencia de anticuerpos contra la misma en sangre es la manera más adecuada.
La necesidad de monitorizar la actividad de L-asparraginasa también se señala en el protocolo nacional de tratamiento de la leucemia linfoblastica infantil. Sin embargo, que nosotros conozcamos, la técnica para realizar esta monitorización y los momentos en que debe de realizarse no están establecidos. Por eso nos proponemos realizar este estudio, para poder protocolizar cuando y de que manera debe de monitorizarse el fármaco. Creemos que una vez que esto haya sucedido nuestros resultados podrían extrapolarse e incluirse en el protocolo nacional.
INICIO DEL PROYECTO: MARZO 2015
Importe del proyecto: 17.500€
DURACIÓN: 2 AÑOS
MEMORIA CIENTÍFICA DETALLADA
L-asparraginasa es un fármaco básico en el tratamiento de la leucemia linfoblástica aguda. Las células necesitan del aminoácido asparragina para sintetizar ADN y poder sobrevivir. Las células sanas son capaces de sintetizar asparragina a partir del aminoácido glutamina. Sin embargo, para las células con leucemia la asparragina es un aminoácido esencial, no pueden sintetizarlo y necesitan de la asparragina que hay en el medio extracelular. El medicamento L-asparraginasa es un enzima que consigue eliminar la asparragina del medio extracelular y, de esta manera, evitar que sea aprovechado por la células cancerosas.
Lo que ocurre con la L-asparraginasa es que, al tratarse de una proteína, el cuerpo la reconoce como una sustancia extraña y es capaz de fabricar anticuerpos contra ella. Estos anticuerpos son los responsables de que ocurran, en ocasiones, reacciones alérgicas a este fármaco. Otras veces, la presencia de estos anticuerpos no produce reacciones alérgicas, pero hacen que la l-asparraginasa esté inactiva y no funcione. Son lo que conocemos como anticuerpos silentes, porque en silencio y sin manifestaciones clínicas son capaces de neutralizar la acción del fármaco.
Existen distintos tipos de asparraginasas, de tal manera que cuando se producen anticuerpos contra un tipo podemos cambiar a otro.
Lo que nos proponemos en el Hospital Universitario Cruces es ser capaces de averiguar si existen anticuerpos silentes contra L-asparraginasa, de esta manera, podría hacerse un intercambio con otro tipo de asparraginasa para garantizar que el fármaco mantenga su actividad. La manera de averiguarlo es a través de una muestra de sangre. Con dicha muestra el servicio de bioquímica del hospital intentará determinar la actividad del enzima L-asparraginasa y los niveles de asparragina en sangre. El laboratorio de inmunología la presencia de anticuerpos. Con esto datos el servicio de farmacia interpretará si el medicamento puede o no actuar de manera adecuada y se lo comunicará a oncología infantil, que cuando tenga suficientes datos constatados será capaz de establecer un protocolo de cambio de tipos de asparraginasa. Pero además se pueden conseguir más beneficios, porque si interpretamos que la actividad del medicamento es excesivamente elevada, podemos establecer protocolos que disminuyan la dosis del mismo y minimicen toxicidades. En definitiva lo que pretendemos hacer es lo que los farmacéuticos llamamos monitorización del medicamento. Como sabemos que no todos los pacientes reaccionan igual ante un medicamento, intentamos buscar “pistas” que nos indiquen porque ocurren estas diferencias. En el caso de L-asparraginasa diferentes grupos han establecido que la determinación de la actividad de L asparraginasa y/o la presencia de anticuerpos contra la misma en sangre es la manera más adecuada.
La necesidad de monitorizar la actividad de L-asparraginasa también se señala en el protocolo nacional de tratamiento de la leucemia linfoblastica infantil. Sin embargo, que nosotros conozcamos, la técnica para realizar esta monitorización y los momentos en que debe de realizarse no están establecidos. Por eso nos proponemos realizar este estudio, para poder protocolizar cuando y de que manera debe de monitorizarse el fármaco. Creemos que una vez que esto haya sucedido nuestros resultados podrían extrapolarse e incluirse en el protocolo nacional.